PROTEÍNAS
Por
el Ing. Agr. Carlos González
Son constituyentes químicos fundamentales e imprescindibles en la materia viva porque:
a) son los "instrumentos moleculares" mediante los cuales se expresa la información genética; es decir, las proteínas ejecutan las órdenes dictadas por los ácidos nucleicos.
b) son sustancias "plásticas" para los seres vivos, es decir, materiales de construcción y reparación de sus propias estructuras celulares. Sólo excepcionalmente sirven como fuente de energía.
c) muchas tienen "actividad biológica" (transporte, regulación, defensa, reserva, etc...). Esta característica diferencia a las proteínas de otros principios inmediatos como glúcidos y lípidos que se encuentran en las células como simples sustancias inertes.
¿Sabía que …?EN EL CUERPO HUMANO LAS PROTEINAS OCUPAN …Las proteínas son muy abundantes, pues constituyen casi la mitad del peso en seco de la célula. En el organismo de una persona adulta, del 18 al 19% de su peso está formado por proteínas, lo que en una persona de unos 70 kg de peso supone unos 13 kg aproximadamente. |
- Composición Química:
Las proteínas están formadas, en
primer lugar, por C-H-O-N y, en menor grado, por S-P-Fe-Cu-Mg-I
Son macromoléculas
orgánicas, formadas por unidades pequeñas llamadas (monómeros) aminoácidos.
|
¿Sabia que ....? LAS PROTEINAS SE CREAN Y SE DESTRUYEN La renovación continua de
las proteínas en el organismo supone la destrucción diaria de 200 a 300
gramos de ellas y la elaboración de otros tantos. Estos procesos requieren un
importante aporte de energía. |
- Los Aminoácidos:
|
H ç H2N — C — COOH ç R aminoácido |
NH2
(grupo amino) COOH (grupo
carboxilo) R (grupo
sustituyente)
|
En la naturaleza existen unos 80 aminoácidos diferentes, pero de todos ellos, sólo unos veinte forman parte de las proteínas. Muchos de estos aminoácidos son polares sin carga y polares con carga.
Los aminoácidos que un organismo no puede sintetizar y, por tanto, tienen que ser suministrados con la dieta, se denominan aminoácidos esenciales; y aquellos que el organismo puede sintetizar se llaman aminoácidos no esenciales. Para la especie humana son esenciales ocho aminoácidos: treonina, metionina, lisina, valina, triptófano, leucina, isoleucina y fenilalanina. Puede añadirse la histidina como esencial durante el crecimiento, pero no para el adulto.
|
|
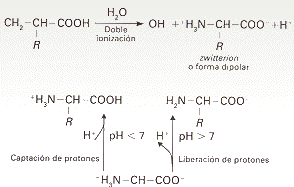
Los aminoácidos son compuestos sólidos, incoloros, cristalizables, de elevado punto de fusión (habitualmente por encima de los 200 ºC), solubles en agua, con actividad óptica y con un comportamiento anfótero (en soluciones neutras se comportan como iones dipolares).
|
|
|
¿Sabia que …? MÁS PROTEINAS, NO SIEMPRE ES MEJOR Las dietas
hiperprotéicas (exceso de carnes, pescados, huevos, leche, etc.) pueden
llegar a ser tóxicas por dos motivos: A) Por una parte, las proteínas digeridas suministran aminoácidos,
pero cuando hay exceso se transaminan y los restos cetoácidos se almacenan en
forma de grasas. La vía metabólica es: ácido oxalacético -> ácido pirúvico -> ácido
acético -> ácidos grasos ->grasas B) Por otra parte, el exceso de grupos amino procedentes de las transaminaciones y los nucleótidos procedentes de los ácidos nucleicos no se eliminan en forma de urea, sino en forma de ácido úrico, que puede cristalizar en las articulaciones, en la piel o en los riñones y originar un trastorno muy doloroso denominado "gota". |
Péptidos y enlace peptídico
Los péptidos son cadenas lineales de aminoácidos enlazados por un enlace químico de tipo amídico al que se denomina “enlace peptídico”. Así pues, para formar péptidos los aminoácidos se van enlazando entre sí formando cadenas de longitud y secuencia variables. Para denominar a estas cadenas se utilizan prefijos convencionales como:
a) Oligopéptidos, si el número de aminoácidos es menor que 10.
Dipéptidos, si el número de aminoácidos es 2,
Tripéptidos, si el número de aminoácidos es 3,
Tetrapéptidos, si el número de aminoácidos es 4,
etcétera.
b) Polipéptidos o cadenas polipeptídicas, si el número de aminoácidos es mayor que 10.
c) Proteína, si el número de aminoácidos es mayor que 100 o el peso molecular es de 10.000.
El enlace peptídico es un enlace covalente y se establece entre el grupo carboxilo (-COOH) de un aminoácido y el grupo amino (-NH2) del aminoácido contiguo inmediato, con el consiguiente desprendimiento de una molécula de agua.
|
|
Por otra parte, el carácter parcial de doble enlace del enlace peptídico (-C-N-) determina la disposición espacial de éste en un mismo plano, con distancias y ángulos fijos. Como consecuencia, el enlace peptídico presenta cierta rigidez e inmoviliza en el plano a los átomos que lo forman.
Clasificación de las proteínas
Las proteínas se clasifican por su estructura tridimensional y por el tipo de aminoácido que la forma y por su interacción.
a) Por su estructura tridimensional
La estructura tridimensional de una proteína es un factor determinante en su actividad biológica. Tiene un carácter jerarquizado, es decir, implica unos niveles de complejidad creciente que dan lugar a 4 tipos de estructuras: primaria, secundaria, terciaria y cuaternaria.
|
-Estructuras Proteicas: * Primaria El ordenamiento es lineal y las uniones son peptídicas. Esta estructura obedece a un plan predeterminado en el ADN. * Secundaria La configuración es
alfa hélice y beta plegada. Las uniones son del tipo puente hidrógeno Ej: miosina
en los musculos , queratina del
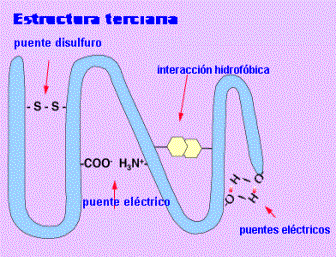
cabello(elásticas), fibroína de la seda (rigidez) * Terciaria La configuración
es globular y las uniones del tipo puente
hidrógeno , puente disulfuro e
interacción electrostática (
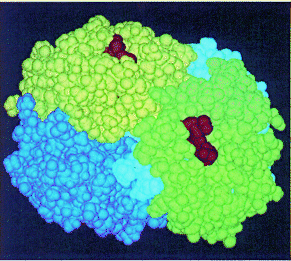
fuerzas de Van der Waals; interacciones iónicas e interacciones hidrofóbicas) de los grupos R Ej: Mioglabina, algunas enzimas. * Cuaternaria Nivel de
organización en la que intervienen dos o más cadenas polipectídicas, que ya
cuentan con estructura terciaria propia. Cada unidad recibe el nombre de protómero Ej: Hemoglobina( cuatro subunidades) y enzimas alostéricas. |
|
Hemoglobina |
Estructura terciaria |
b) Por el tipo de aminoácido que la forma y por su interacción:
|
Clasificación: - Proteínas Fibrosas: ( Colágeno- queratina del pelo, plumas y uñas-
fibroína de la seda- elastina de los tendones)
- Proteínas globulares: (Microtúbulos- enzímas - hormonas)
|
|
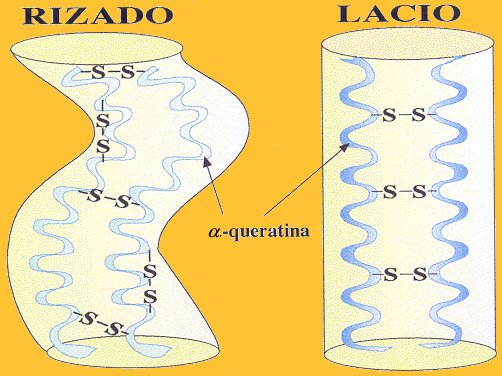
¿Sabia que …?. CABELLO LISO / CABELLO RIZADO
La forma del cabello, liso
o rizado, depende de la manera en que se establezcan los puentes disulfuro entre
las moléculas de queratina. En los cabellos lacios, los puentes disulfuro
entre las alfa-hélices de la queratina se establecen al mismo nivel, mientras que en los cabellos rizados los
puentes establecen uniones entre regiones que se sitúan en diferente nivel,
como cuando abrochamos mal los botones de una chaqueta.
|
- Efectos del PH y la temperatura en las proteínas:
Los cambios de pH y la temperatura alta, como así también una salinidad alta y la agitación molecular, producen la ruptura de la configuración espacial de la proteína.
Cuando se rompen los enlaces que mantenían sus estructuras cuaternaria, terciaria y secundaria, conservándose solamente la primaria, la proteína pierde su característica, se desnaturaliza, transformándose en filamentos lineales y delgados que se entrelazan hasta formar compuestos fibrosos e insolubles en agua. A este proceso se lo denomina coagulación. Es irreversible y ocasiona la pérdida de la actividad biológica de la proteína.
|
Funciones de las Proteínas:
|
Recordemos …ESPECIFICIDADEs una de las propiedades
más características de las proteínas y consiste en la capacidad de cada una
de las especies de seres vivos de fabricar sus propias proteinas (diferentes
de las de otras especies) Además, dentro
de una misma especie hay diferencias proteicas entre los distintos
individuos. Esto no ocurre con los glúcidos y lípidos, que son comunes a
todos los seres vivos. La enorme diversidad
proteica interespecífica e intraespecífica es la consecuencia de las
múltiples combinaciones entre los aminoácidos, lo cual está determinado por
el ADN de cada individuo. La especificidad de las proteinas explica algunos fenómenos biológicos como la compatibilidad o no de transplantes de órgános; injertos biológicos; sueros sanguíneos; etc... o los procesos alérgicos e incluso algunas infecciones. |
¿Sabía que ...?EL RECHAZO DE LOS TRANSPLANTESEl principal
obstáculo para el éxito en los trasplantes de órganos e incluso en los
injertos de determinados tejidos orgánicos es el propio sistema inmunológico del
receptor, que puede reconocer como "extrañas" partículas biológicas
proteicas (antígenos HLA) del nuevo órgano o tejido y poner en marcha los
mecanismos de defensa contra el órgano o tejido trasplantado, de manera
similar a como lo haría contra otros agentes extraños (bacterias, virus,
hongos, parásitos, etc...). Cuando esto ocurre se produce la muerte celular
en el órgano transplantado y, por tanto, la destrucción del mismo. SEGÚN EL TIPO DE SANGRE, ALGUNOS PUEDEN SER RECEPTORES Y OTROS, DONANTESEn la membrana de
los glóbulos rojos existen diversos tipos de proteínas, determinadas
genéticamente, que tienen carácter de antígeno, es decir, que introducidas en
un organismo que no las posea, lo estimulan a la formación de anticuerpos, y
por tanto, a eliminarlos. La presencia o ausencia de dos antígenos concretos, "A" y
"B", en las envolturas de los eritrocitos y, al mismo tiempo, la
presencia o ausencia de anticuerpos específicos contra "A" y/o
contra "B", determinan la clasificación de la sangre humana en
cuatro grupos diferentes: "A" (si sólo está presente el antígeno A
y el anticuerpo B), "B" (si sólo está presente el antígeno B y el
anticuerpo A), "AB" (si están presentes los dos tipos de antígenos
y ningún tipo de anticuerpo) y O (si no están presentes ningún antígeno y los
dos tipos de anticuerpos). Si mezcláramos dos tipos de sangre distintos, con antígenos y anticuerpos "complementarios" (A y anti A; B y anti B), la sangre se aglutinaría como consecuencia de la reacción "antígeno - anticuerpo". Así pues, transfundir a alguien sangre de un grupo sanguíneo que no sea compatible con el suyo puede resultar fatal. |
|
Escala de Energía de los distintos
compuestos orgánicos:
|