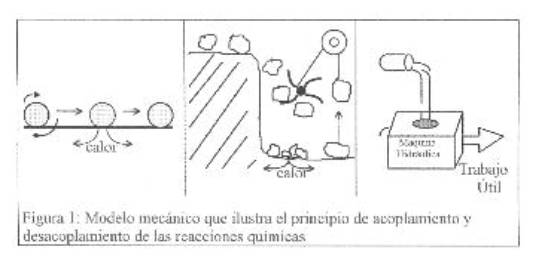
Enzimas
Por
el Ing. Agr. Carlos A. González
Recordemos las reacciones endergónicas
y exergónicas:
|
|
Para armar una molécula
hacen falta muchos elementos, a saber:
1. Materia prima con la
cual construir
2. Operarios especializados: las enzimas
3. Transferencia de electrones y de materiales
preelaborados (dentro o fuera de la célula)
4. Energía para unir los átomos en las combinaciones
deseadas.
Las enzimas son las moléculas responsables de
"elegir" entre una enorme cantidad de reacciones posibles, cuáles de
ellas van a ocurrir y cuáles no.
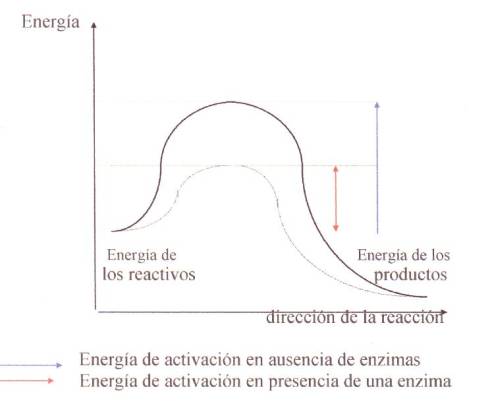
¿Cómo se maneja la energía con las enzimas?
Las enzimas, en su calidad de catalizadores
biológicos, disminuyen la energía de activación de determinadas
reacciones químicas. Esto quiere decir: logran que sea necesaria una menor
cantidad de energía inicial para que una cierta reacción se produzca, y esto lo
hacen al combinarse con ciertas moléculas biológicas, seleccionando así, entre
varias alternativas, cuál será la vía que se seguirá.
|
|
Características de las enzimas:
·
Actúan
en baja concentración
- No sufren modificaciones durante la reacción
- Se recupera intacta
- No afecta el equilibrio de la reacción, pero si su velocidad
- Son específicas
- Su actividad está regulada
- Es una proteína
Teoría
sobre la actividad enzimática:
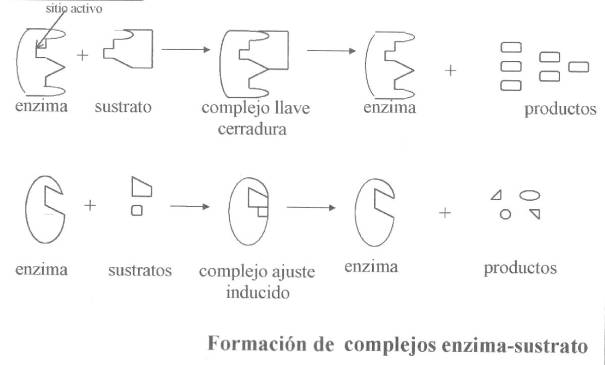
¿Cómo actúan las enzimas?
Sustrato + Enzima ------> (Enzima-Sustrato)-------> Producto
|
|
¿Cómo se establece la unión específica de la
enzima con su sustrato?
·
El sitio Activo:
En las enzimas existe una zona o surco que
comparte cierta complementariedad tridimensional con el sustrato. En este surco
existe complementariedad de cargas o de densidades de carga, con el sustrato;
lo cual depende de los aminoácidos que queden en esa zona que, a su vez
corresponderá, en últimas instancia, a la estructura primaria de la proteína.
·
Características del sitio activo:
1. Responde a una porción
relativamente pequeña del volumen total de la enzima.
2. Es una entidad tridimensional.
3. Los sustratos se unen a las enzimas por numerosas
fuerzas débiles.
4. Presentan forma de surco o hendidura
5. La especificidad depende de la disposición exactamente
definida de los átomos del centro activo.
Cofactores:
Son sustancias de características no proteicas
que, actúan junto con la enzima y el sustrato, en algunas reacciones.
Estas sustancias:
·
no
se modifican al finalizar la reacción,
- si sufren alguna modificación durante la reacción, pero se
regenera en una reacción acoplada.
Tipos de cofactores:
·
Iones:
manejan las cargas de los sitios activos. Ej.: Mg es
cofactor de las enzimas que transfieren grupos fosfato.
- Coenzimas: produce interacciones débiles y colaboran con los
procesos anexos a las funciones catalíticas en sí. Ej.: NAD, NADH y ATP.
- Grupos prostéticos: Son sustancias que se unen en forma covalente
con la enzima siendo imposible separarlas.
|
Haloenzima = Apoenzima
+ Grupo prostético |
Ej.: En las catalasas
y peroxidasas de los peroxisomas,
es el Hemo.
Las flavinas (FAD,
FMN).
Mecanismos de regulación de la
actividad enzimática:
Las enzimas están reguladas en las vías
metabólicas de un modo coordinado y económico, ajustándose a las necesidades de
la célula.
Objetivos de la regulación:
1. Producir los metabolismos
necesarios y en la cantidad adecuada cuando son requeridos. (máx. economía).
2. Aprovechar la energía disponible en forma eficiente.
3. Mantener un control de las fuentes energéticas.
4. Mantener un nivel adecuado de ATP.
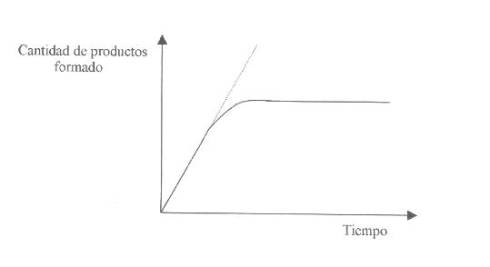
Factores que afectan la cinética enzimática:
La cinética de una reacción se refiere a la
velocidad de dicha reacción a medida que transcurre.
La reacción se puede medir: la cantidad de
Producto formado en cada unidad de tiempo (por minuto).
|
|
Los fenómenos que afectan la cinética
enzimática son:
A. Efectos de la
temperatura
B. Efectos del pH
C. Efectos de la concentración del sustrato
D. Efectos de la concentración de cofactores
E. Interacción con los activadores e inhibidores
1. Inhibidor irreversible
2.
Modulación
reversible
a. A nivel del sitio activo
b. En otro sitio diferente al sitio activo
Existen otros niveles de regulación:
F. Interconversión de formas enzimáticas
G. Control genético
a. Enzimas induscibles.
b.
Enzimas
constitutivas.
H. Control Hormonal
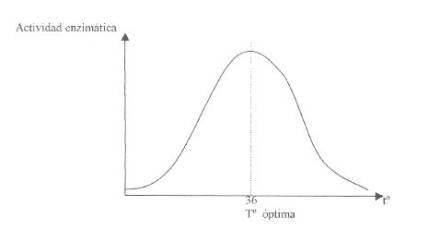
A. Efecto de
|
|
A
Mayor Tº (de la óptima), mayor desestabilización de
las estructuras (desnaturalización).
A
Menor Tº ( de la óptima),
mayor rigidez de las uniones débiles (menor flexibilidad conformacional).
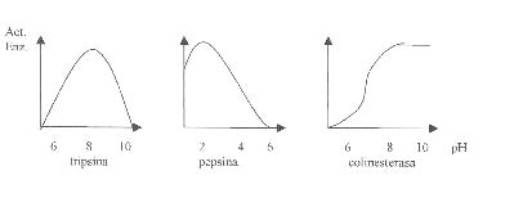
B. Efectos del pH
|
|
¿Cómo influye el pH en
una enzima?
·
Se
altera se la estructura, por ionización de su grupos R en los aa.
- Alteración de las cargas, de los sitios activos
- Se pueden alterar los grupos funcionales responsables de la acción
catalítica.
- El pH, puede levar a la
desnaturalización parcial o total.
Algunas enzimas muestran rangos de trabajo a
temperaturas específicas y otras le es indiferente.
|
|
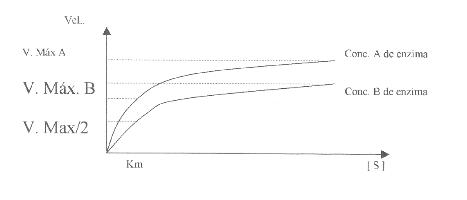
C. Efectos de
·
Concentración
de Saturación
- Velocidad máxima
- Velocidad inicial
|
|
|
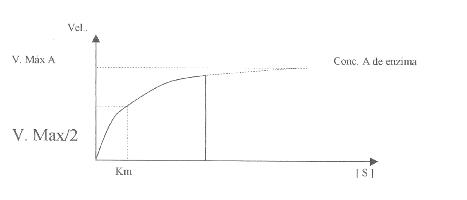
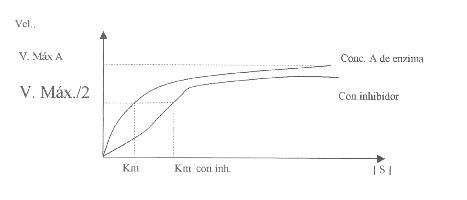
Km de una enzima es: "La
concentración de sustrato para la cual la velocidad de reacción corresponde a
la mitad del valor de la velocidad máxima". |
D. Concentración de
Cofactores:
La
enzima que precisan de cofactores para ser activadas se verán
limitada su actividad a la presencia de estos cofactores en concentraciones
adecuadas.
A
Menor cantidad de cofactores, Menor es la cantidad de productos.
E. Interacción con activadores o inhibidores:
1. Inhibición irreversible.
|
|
.
Modificación
del sitio activo
.
Inhibición de tipo covalente.
Ej.:
Penicilina. Metales pesados. Organofosforados (DDT,
DFT),
2.
Modulación
reversible:
a. a nivel del sitio activo:
|
|
.
La interacción con el sitio activo, es competitivo
.
Depende de la concentración de sustrato o de inhibidor.
En
la inhibición competitiva la velocidad máxima de la reacción no varía, pero se
necesitan concentraciones más elevadas de sustrato para alcanzar una
determinada velocidad, incrementándose así
Inhibición reversible competitiva.
Ej.:
Etilenglicol., Propolio
b.
En otros
sitios diferentes al sitio activo:
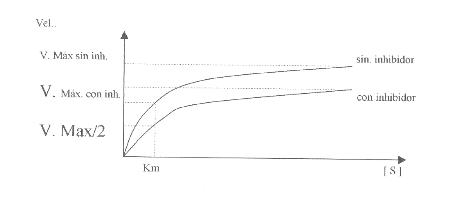
1. Inhibición reversible
no competitiva en enzimas Michaelianas.
Son
sustancias que actúan fuera del sitio activo, pero alteran la conformación
tridimensional del mismo, disminuyendo la afinidad por el sustrato. Ej.:
Sustancias metabólicas (H2O2).
|
|
2. Modulación reversible no competitiva en enzimas alostéricas:
|
Las enzimas alostéricas poseen un sitio receptor llamado sitio alostérico. Estas enzimas poseen más de una cadena polipectídica a cada una de las cuales corresponde un
sitio activo. El sitio alostérico suele localizarse
en la unión de los polipectidos. |
|
|
Estas enzimas presentan un efecto cooperativo:
la unión de un sustrato a unas de las subunidades de
la enzima, facilita la unión de las demás moléculas de sustrato a los sitios
activos de otras subunidades.
Si
un sustrato forma un enlace covalente con un sitio distinto del activo, ello
puede estimular la actividad de la enzima o bien inhibirla. La
sustancia que se
une a la enzima alostérica se llama regulador o
modulador o efector.
|
|
|
* + la afinidad por el sustrato
aumenta, y el efecto cooperativo se reduce. * - la afinidad por el sustrato
disminuye, y el efecto cooperativo aumenta.(provocando
la necesidad de una [ S ] mucho mayor para alcanzar una determinada
velocidad). |
·
Existen
algunas enzimas que presentan un solo sitio activo y varios sitios alostéricos en una sola cadena polipeptídica, dependiendo
su actividad del balance de los tipos de efectores que se unan.
- Otras enzimas por ej.: del tipo alostérico
formada por dos subunidades, una de ellas
presenta el sitio activo y la otra el o los sitios alostéricos.
|
Debemos tener claro.... a.
Que
una enzima alostérica puede ser regulada por una
inhibición competitiva.
|
¿Cómo controla la velocidad de la vías metabólicas?
¿Cómo se hará para acelerar o retardar las
reacciones metabólicas en la célula en función de las necesidades?
Por medio de:
Feddback negativo o inhibición por
producto final.
Feddback positiva o activación por
precursor.
A. Interconversión de formas enzimáticas:
·
Enzimas
que se pueden presentar en dos formas: activa o inactiva.
- Enzimas que pueden pasar de una forma activa a una inactiva o
viceversa.
- Enzimas que sufren una modificación:
a. covalente por otra
enzima,
b.
por otra
proteína: Calmodulina
c.
Por alguna
sustancia específica que producen un clivaje
en una cadena polipeptídica, dejando libre el sitio activo (enzimas proteolíticas).
·
Las
modificaciones son reversibles.
- Ej.: * Enzimas activadas por fosforilación: Quinasas
y Fosfatasa
* Calmodulina(sensor de Ca en células
eucariontes).
·
El
pepsinógeno (zimógenos)
se activa por pH ácido del estomago, como pepsina. El
tripsinógeno se produce en el páncreas se activa en
el intestino con pH alcalino como tripsina.
G. Control genético:
·
Enzimas constitutivas:
Son
aquellas en que las células las fabrica todo el tiempo. Siempre están allí en
niveles "basales". Esté o no el sustrato en
ese momento. Ej.: las enzimas de la vía glucolítica.
·
Enzimas inducibles:
Son
aquellas enzimas que se sintetizan cuando su sustrato está presente en la
célula.
·
Regulación génica de los procariontes:
1. Los genes codificadores
(operón) están muy próximos entre sí.
2.
Se encienden y
apagan al unísono.
3.
El gen
que controla el conjunto de genes se llama operador (interruptor).
4.
El gen que
acciona el interruptor se llama gen regulador. Este produce una
proteína represora.
5.
El represor se adhiere,
al operador y de esa manera lo mantiene en posición de apagado.
6.
Cuando en el
medio hay cierta sustancia, estar reaccionan con el represor e impide que se
adhiere el operador.
7.
El resultado es que
el operón deja de estar reprimido y se enciende. Frente a esta situación,
8.
La sustancia que
nulifica al represor se denomina inductor.
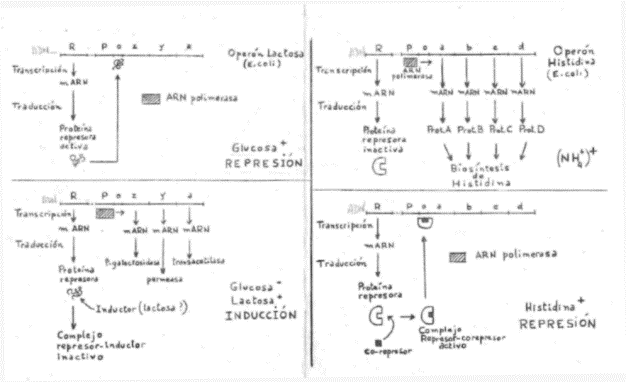
Ej.: Operón lactosa y Operón histidina (fig.1).
|
Fig. 1 |
|
Enzimas: Beta-galactosidasa: rompe la lactosa en glucosa y
galactosa. Permeasa: facilitas el paso de la lactosa al
interior de la célula bacteriana. Transacetilasa: promueve la transferencia de un grupo
acetilo del acetil-oA a
la galactosa, sin participar directamente en el procesamiento de la lactosa. |
Las funciones de los represores, tanto activos
como inactivos, es un ejemplo de los mecanismos de control negativo de
la expresión génica; sin embargo, también existe mecanismos positivos de
control.
Por ejemplo positivo para el operón lactosa se
relaciona con una proteína llamada CAP (proteína fijadora del AMP
cíclico) capaz de combinarse con el AMP cíclico (sustancia
mensajera que media los efectos de muchas hormonas sobre la actividad celular).
1. En presencia de AMP
cíclico,
2.
Cuando esta
proteína se fija al AMP y se adhiere al promotor, altera la conformación de
éste último y, de ese modo, aumenta la capacidad del promotor para fijarse a
3.
En presencia de
glucosa (fuente de energía directa), las concentraciones de AMP cíclico son
bajas y los CAP no se fijan al sitio promotor, no activando
4.
Cuando las
concentraciones de la lactosa es alta y en ausencia de glucosa, la
concentración de AMP cíclico se eleva y este forma un
complejo con el CAP, la cual se adhiere posteriormente al sitio promotor del
operón lactosa activándolo.
·
Regulación génica de los eucariontes:
La regulación de estos individuos es más
compleja aún, existiendo diferencias cualitativas y cuantitativas.
¿Porqué?
1. El número de genes en el
genoma total de los eucariotas es hasta 800 veces
mayor que el de los procariotas.
2. En una célula eucariota, perfectamente el 99 % de los
genes potenciales pueden estar apagados.
3. El material genético traducible del eucariota está interrumpido
por secuencias intermedias que no se expresan.
|
Sabía que
... muchos de los segmentos de ADN que participan
en la codificación de las proteínas están interrumpidos por segmentos de nucleótidos
que carecen de información genética. Las bandas codificadoras se llaman exones, mientras las regiones no
codificadoras se conocen como intrones.
En general, los genes están divididos en partes intrónicas
y exónicas aproximadamente iguales, aunque en
algunos casos las partes intrónicas son superiores. El ARN inmaduro formado a
partir del ADN no es el mismo que pasa a través de la membrana nuclear, pues
se retiran los tramos que no codifican y se unen los tramos que sí codifican
(exones) formando la cadena de ARN maduro que pasa
al citoplasma. |
H. Control hormonal:
Este
sistema de control es específico de los individuos pluricelulares, poseen
sistemas endócrinos, productores de hormonas.
Las
hormonas son mensajeros químicos producidos por glándulas especiales, que
viajando vía sanguínea a un determinado lugar (tejidos, órganos, etc.) donde
cumple su función. Para que dicha función pueda ser desarrollada, el lugar de
destino debe presentar receptores específicos (glucocalix).
Las
hormonas por sus características químicas (hidrosoluble o liposoluble) deben
llevar el mensaje y transmitirlo al interior de la célula de dos formas
diferentes.
A)
Para el caso de las liposolubles (ej. Esteroides), atraviesan las membranas se
unen a una proteína receptora dentro del
citoplasma y el complejo resultante ingresa en el
núcleo donde ocurre el efecto sobre el aparato genético.
B)
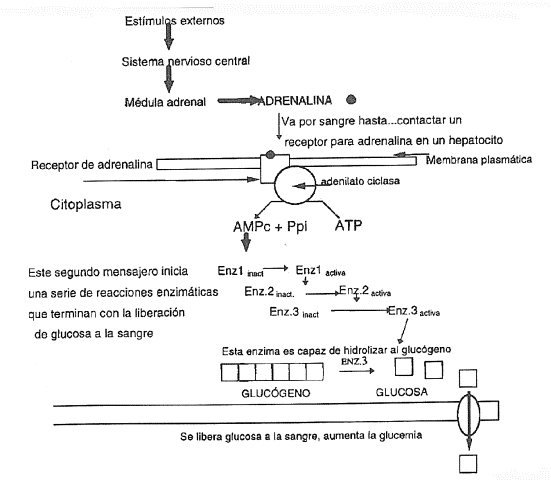
En el caso de las hidrosolubles, se deben fijar previamente a un receptor
específico presente en la membrana celular. Pero para pasar el mensaje al
interior se necesita de un segundo componente que sea cómplice y que se
encuentra en el interior de la célula: el AMP cíclico ( en otros casos el ion
calcio, el inositol trifosfato
o el GMP cíclico teniendo el mismo propósito). El mecanismo es el siguiente
(fig.3):
1. La hormona se adhiere al
receptor membranoso.
2.
El traslado de la
señal a través de la membrana se lleva a cabo por una proteína llamada proteína transductora ( proteína
G).
3.
Se activa una
enzima que se encuentra sobre la cara que da hacia el citoplasma llamada: adenilato ciclas. Esta enzima
quita dos fosfatos al ATP, produciendo AMP cíclico, que actúa como segundo
mensajero enviando el mensaje al citoplasma.
4.
A partir de este
punto se desencadena una serie de reacciones en la célula.
5.
Luego
otra enzima, la fosfodiesterasa,
degrada el AMP cíclico a AMP sencillo, terminando así la acción hormonal. Más
tarde el AMP es reciclado a ATP.
|
Fig.3 |
Por
lo general, este mecanismo de acción hormonal (B) es más veloz que los
mecanismos que implican una modulación del genoma (A). La modulación de la actividad
génica puede consistir en un incremento de la transcripción
o de la traducción.
Tipos de enzimas:
El nombre de la enzima consta de dos partes. La
primera corresponde al nombre del sustrato - o -, la segunda, que
termina en "asa", al tipo de reacción que cataliza.
Las enzimas se clasifican en seis clases:
a. Oxido-reducción:
reacciones redox. Ej.: deshidrogenasas.
b.
Transferasas: transfieren grupos funcionales de una molécula a
otra. Ej.: transaminidasas
c.
Hidrolasas: introducen moléculas de agua en uniones específicas
de sustratos. Ej.: amilasas
d.
Descarboxilasa: eliminas CO2 de la moléculas.
e.
Liasas: Eliminan un grupo del sustrato dejando una doble
ligadura o adicionan un grupo a una doble ligadura.
f.
Isomerasas: Reordenan al sustrato.
g.
Ligasas: unen dos moléculas entre sí con obtención de la
unión pirofosfato del ATP o de otro nucleótido trifosfato.
Sabia
que ...
Hace pocos años, se desarrolló un
descubrimiento relacionado con enzimas de ARN (llamada ribozimas).
Se trata de una molécula de ARN procedente del intrón
de un ARN ribosómico autoenzamblado de un protozoo ciliado que actúa como una ribonucleasa
y una ARN polimerasa. Esta enzima demuestra un alto
grado de especificidad, cinética de Micheaelis y
susceptibilidad a la inhibición competitiva. En la evolución, las enzimas de
ARN pueden preceder a las enzimas proteicas.