Los Priones
![]()
Desde 1892, cuando el botánico Iwanowski descubrió que "el virus del mosaico del tabaco" se transmitía a las plantas sanas cuando se ponía en contacto con savia de la planta enferma, hasta hoy que todavía no nos han revelado los virus toda su información, aparecen en el mundo microscópico otras formas acelulares de menor tamaño, capaces de causar enfermedades. Estas formas son los viroides y los priones.
- Viroides
Son moléculas de ARN circular que carecen de cualquier protección. Infectan a plantas a las que causan enfermedades importantes, como el atrofiamiento de la planta del tomate, y el tubérculo filiforme de la patata.
Su tamaño es menor que el del cualquier genoma vírico, posee entre 250 y 405 nucleótidos y aunque este tamaño parece suficiente para codificar una proteina, carece de sitios de unión para los ribosomas, de codones de iniciación y de codones de terminación.
Es muy probable que la enzima ARN-polimerasa del hospedador se encargue de su replicación. A este respecto el viroide es totalmente dependiente del metabolismo del huésped para su replicación.
Estas moléculas aparecen en el núcleo de la célula hospedadora e
interfieren en la regulación de los genes que allí se expresan, concretamente
en los que codifican para determinadas hormonas.
2.
Priones.
Son agentes patógenos formados por una proteína ( proteína del prión o PPr ). Producen entre otras, la enfermedad de las "vacas locas" o encefalopatía bovina espongiforme. Esta proteína se acumula en el cerebro de animales enfermos , dando lugar a la estructura esponjosa de la corteza cerebral que da nombre a la enfermedad.
Los priones, o las enfermedades producidas por priones, tienen un comportamiento sorprendente, por un lado se transmiten verticalmente , como cualquier enfermedad hereditaria típica, mientras que por otro lado se comportan de manera infectiva, transmitiéndose horizontalmente, mediante contagios que pueden darse entre individuos de distintas especies.
La proteína del prión (PrP) normal, tiene una secuencia de aminoácidos, (estructura primaria) idéntica a la proteína del prión patógena. La diferencia entre las dos recae en la estructuras secundaria y terciaria ,
|
Proteína del prión normal |
Proteína del prión patógena |
Proteína patógena infectando a una normal |
La proteína normal es muy rica en hélices alfa, la proteína patógena lo es en láminas beta.
|
|
|
Este cambio de configuración es crucial, ya que las proteínas con láminas beta son muy resistentes a las enzimas proteolíticas, al calor y no se disuelven en agua. Pero sobre todo, la proteína alterada tiene una característica única: interacciona con una molecula de proteína normal, le cambia la conformación y la hace capaz de convertir las estructuras de más proteínas normales. Ahí radica al parecer, el poder infectivo de los priones.
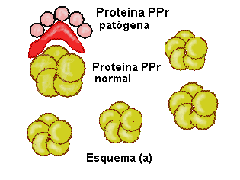
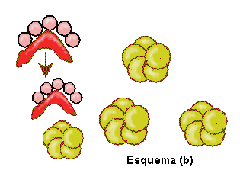
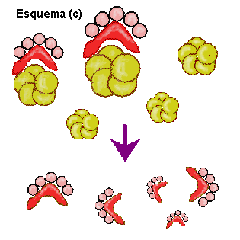
En el esquema siguiente se intenta explicar este proceso.
|
|
|
|
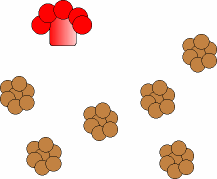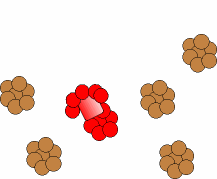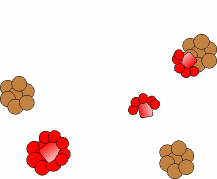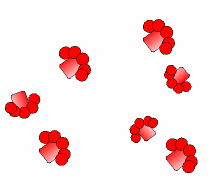
Puede ocurrir que la proteína patógena infecte individuos que producen proteína
normal (a), como ha ocurrido por ejemplo al consumir las vacas piensos
elaborados a partir de de ovejas enfermas. En este caso la proteína
patógena origina un cambio conformacional de la proteína normal
(b), transformando las hélices alfa de su estructura proteíca en láminas beta.
Las nuevas proteínas patógenas inducen el cambio en otras normales, lo cual
produce un efecto de "cascada".
El proceso se simula con esta animación
![]()
Artículo: “Con la Mira en los Priones”.